| Меню сайта |
 |
|
|
 |
| Мини-чат |
 |
|
|
 |
| Статистика |
 |
| |
 | |
|
Recent Advances in Diaper Dermatitis: Etiology and Treatment
| |
| wahib |
Дата: Воскресенье, 16.08.2009, 20:36 | Сообщение # 1 |
 Египет Группа: Пользователи
Сообщений: 30
Статус: Offline |
Recent Advances in Diaper Dermatitis: Etiology and Treatment Abstract and Introduction
Abstract Diaper dermatitis is a highly prevalent condition that causes discomfort and stress for patients and frustration for healthcare staff. Diaper technology has evolved to substantially lessen the severity of diaper dermatitis, but additional improvements are needed. Premature infants and incontinent adults are particularly at risk for developing diaper dermatitis and its potential consequences. Contributing factors include overhydration, irritants, friction, increased skin pH, diet, gestational age, antibiotic use, diarrhea and medical condition. Treatments aim to reduce hydration, provide a semipermeable 'layer' to facilitate skin barrier repair, shield the skin from irritants, deactivate specific fecal components and maintain skin surface contact. The published research on the effects of diaper dermatitis treatments is especially sparse. Controlled clinical trials are needed to provide definitive evidence for selection of effective treatments. This article discusses the incidence and etiology of diaper dermatitis in infants and adults. It provides the scientific basis for repair of diaper skin barrier damage and describes recent developments that will be available in the future. Introduction In addressing diaper dermatitis (DD), we encompass the most recent views about the skin structure, function and development with the foundation that the skin is an interface for primary care in any patient-caregiver interaction.[1] Normal Skin Physiology
Human skin is a highly dynamic interface that protects the organism by multiple mechanisms. It provides innate immunity by functioning as a physical barrier and deterrent for pathogenic microbial invasion. The stratum corneum (SC) serves as a barrier to internal water loss and to external insults (irritants), generates the acid mantle and provides antioxidation. The viable epidermis continually renews the SC, protects against UV damage, regulates temperature, participates in sensory transduction, provides tactile discrimination and resists frictional damage.[2-4] The epidermis has redundant mechanisms that immediately initiate tissue repair in the event of skin injury or compromise. An acidic SC pH is required for the action of enzymes involved with the formation and integrity of the SC (i.e., lipid metabolism, bilayer structure, ceramide synthesis, cell cohesion and desquamation).[5,6] Barrier recovery after injury can be increased by the application of an acidic buffer (pH 5.5).[7] An acidic pH contributes to the innate immune function by inhibiting the colonization of pathogens.[4] Epidermal Barrier Development
The full-term neonate has a well-developed and effective epidermal barrier at birth, despite exposure to water and amniotic fluid for 9 months. At birth, neonatal skin provides thermal regulation, a barrier to water loss and chemical exposure, tactile discrimination, infection control, immunosurveillance, antioxidation and acid mantle formation. Transepidermal water loss (TEWL, g/m2/h) is equal to or lower than adults, and indicating a highly competent barrier.[8,9] Skin hydration decreases rapidly and then increases during the first two postnatal weeks, indicating adaptive changes in the upper SC.[10] Increasing hydration was attributed to changes in SC water handling properties. Levels of water soluble amino acids (i.e., natural moisturizing factor [NMF]), in the upper SC of full-term infants were extremely low.[11] NMFs may be extracted into the amniotic fluid. In addition, the proteolysis of filaggrin that generates NMF may be activited as part of the adaptation to dry conditions. The skin surface pH is neutral at birth, decreases significantly during the first 1-4 days and continues to drop during the first 3 months for full-term infants.[12-14] Newborn SC contains active host-defense proteins (i.e., lysozyme and lactoferrin). Lysozyme concentrations and muramidase activity were fivefold higher in neonates and were not altered with routine bathing.[15]
Usually, the continual exposure to water results in skin maceration, barrier disruption and subsequent epidermal injury, raising the question of how the infant develops an excellent barrier while in water. Vernix caseosa is believed to play a significant role in barrier development. Vernix is a complex mixture of 80% water, 10% protein and 10% lipids with corneocytes embedded in a lipid matrix that coats the skin from head-to-toe and back-to-front during the last trimester.[16] The remarkably high water is associated with the cells. Vernix formation is believed to be under hormonal control with lipids generated from the sebaceous gland cells in the hair follicles. It is extruded onto the interfollicular epidermis to cover the whole surface.[17] Presumably, vernix forms a hydrophobic layer to protect the epidermis from water exposure and create favorable conditions for cornification and SC formation. Vernix contains antimicrobials (e.g., lysozyme and defensins) that were effective against specific organisms.[18] In parallel newborn cohorts, vernix retention resulted in significantly higher skin hydration 24 h after birth compared with vernix removal.[19] Skin pH values were lower suggesting that vernix facilitates the development of the acid mantle. Overall, vernix caseosa plays a role in the development of the SC barrier through a variety of protective and adaptive mechanisms. The WHO recommends waiting for at least 6 h prior to bathing newborn infants. High-risk Patients: Premature Infant Skin
The premature infant has a poorly formed barrier with few cornified layers.[20,21] For infants at 24-25 weeks gestation, barrier maturation occurred but TEWL was still significantly higher at 1 month, compared with full-term infants.[22] Preterm neonates younger than 28 weeks gestation lack the covering of vernix caseosa. Estimates of the time to full barrier maturation vary from 2 to 9 weeks postnatal age.[22-25] Environmental humidity influences barrier development. Exposure to 10% relative humidity demonstrated reduced skin hydration but increased epidermal DNA synthesis, suggesting that low hydration may trigger cell proliferation.[26] An abnormal desquamation pattern is often observed for several weeks in very premature infants. Humidity also impacts epidermal filaggrin proteolysis to water soluble amino acids (NMF) that facilitate SC water binding.[27] At birth, proteolysis (animal model) occurred at 80-95% humidity, but not at high or low humidities, suggesting that NMF generation depends upon ambient water activity.[28] Without adequate levels of NMF, the SC is dry, has low water-holding capacity and does not desquamate properly. NMF levels are expected to be very low under the conditions of rapid SC development experienced by premature infants. Skin pH decreased for 4 weeks after birth in very low birthweight infants, varied with gestational age and was higher for a longer period in those less than 1000 g.[29] The time to completion of the acid mantle development may be longer in premature than in full-term infants. During barrier development, the preterm infant is at risk for increased permeability to exogenous agents and skin damage. Significance: Incidence of Diaper Dermatitis Diaper dermatitis is a highly prevalent condition that can cause discomfort and stress for patients and frustration for healthcare providers.[30,31] Irritant DD is the result of progressive barrier compromise and is characterized by dryness/scaling, aberrant desquamation and erythema (Figure 1). More severe cases have eruptions, papules, vesicles, more intense erythema and ulcerations (excoriation). A numerical severity scale was developed to reflect the etiology of the diaper skin irritation and was based on the extent of damage and area of involvement.[32] The 0-4 scale encompasses skin integrity (scaling and ulceration), erythema (spotty, continuous) and eruptions (papules, vesicles and edema), and severities of very slight, slight, moderate, moderate-severe and severe ( Table 1 ). Excluding atopic dermatitis, psoriasis and seborrheic dermatitis, irritant DD includes generalized contact irritant dermatitis, miliaria, intertrigo and candidiasis.[33] Figure 1. Common sequence leading to irritant diaper dermatitis. Initial events involve compromise to the integrity of the stratum corneum barrier. Once the barrier is damaged, chemical and/or mechanical irritants cause inflammation (erythema). Continued irritant exposure can result in excoriation, rash and In a study of 1089 community-based infants, half had visible diaper skin compromise measured as visible dryness and/or erythema and 5% had severe lesions.[32] Approximately half (53%) used disposable diapers exclusively, 43% used both cloth and disposable diapers and 4% used cloth exclusively. Of the 1500 community-based infants who used disposable diapers with absorbent gel polymer, 33% had mild dermatitis and 2-6% had severe cases.[34] A survey of 1773 hospital nursery staff was conducted to determine the characteristics of DD among typical patients. Perineal eruption as the most common type (73%), rash in the perineal or entire area (17%), rash with perianal noduli (4.5%), psoriasis like rash (1.7%) and partial eruption of infantile dermatitis (1.5%).[35] However, the diaper types were not reported. Mothers of 12,103 infants completed surveys regarding DD and 25% of their infants had experienced diaper rash, judged as mild, quite bad or very bad.[36] A total of 34% used cloth diapers only, 25% used disposable diapers exclusively and 33% used a mixture of diaper types. A total of 1 million visits per year to outpatient pediatric offices for DD (also including balanitis, vulvovaginitis, intertrigo and candidiasis) have been reported.[37] Specific diapering practices (e.g., diaper type and use of rash treatment) were not provided. Among 532 infants (preterm to 24 months old) from one site (83% hospitalized, 17% outpatient clinics) defined DD as 'rash believed by parents to be caused by wearing a diaper' and 52% had at least one event.[38] Of the total number of infants involved, 15% had three or more rash events and 99% of the infants used disposable diapers. A 1-day assessment of 283 infants (7 months to 11 years) in a pediatric tertiary-care hospital demonstrated that 60% were incontinent.[39] DD was found in 16% and of them, 12% had Candida, 63% had an intact epidermis and 25% had greater compromise (epidermis not intact). Diaper type was not specified. Among 1064 inpatients (birth to 17 years) in nine US children's hospitals, the skin breakdown prevalence rate (excluding pressure ulcers) was 14.8%[40] and diaper skin compromise was found in 42% of those cases.[40] Details regarding diaper type and rash treatments were not reported. DD was not present at birth in 31 healthy full-term neonates but by day 14, the mean score was 1.0 and 90% had skin compromise, particularly in the anal/perineal region.[41] By 1 month, 29% had scores of 1.5 and rash (papules). The same type of disposable diaper was used by all subjects.
The published literature on the incidence and severity of DD in the nursing home population is limited.[42] At least 50% of residents are incontinent.[43] Among 1918 residents (16 facilities in 15 states), 63% were incontinent and 3.5% had mild (light redness, intact skin and slight discomfort), moderate (medium redness, skin flaking/peeling, small regions of shallow broken skin or small blisters) or severe (intense redness, rash, deeper skin peeling or erosion, large blisters or weeping skin, pain) dermatitis.[42] Severity scores were not reported. Among 46 patients, the types were irritant dermatitis (16%), candidiasis (63%), eczema (11%) and psoriasis (11%).[44] Approximately 75% of elderly diaper-wearing subjects have dermatitis with 50% as mild, 20% as moderate and 5% as severe cases.[45] Schnelle et al. determined the frequency of maceration, dryness/scaling, rash (papules), edema, macules and blanchable erythema in the diaper area in 100 incontinent nursing home patients (87.3 ± 8.0 years).[46] Blanchable erythema was the most common feature, found in 94% of subjects typically in the front and back. Skin moisture was highest in the back perineal region.
In summary, DD is a common condition, although reported frequencies vary depending on specific methodologies. Determination of the severity of DD is hampered by the lack of standardization of the definition and use of different grading schemes and assessment tools. Despite these limitations, the majority of diaper rash cases fall into the category of contact irritant dermatitis. Etiology of Diaper Dermatitis
Several features of the diaper environment predispose the skin for damage. They include overhydration, contact with skin irritants (e.g., urine, feces, associated enzymes and bile salts), mechanical friction (skin-diaper and skin-skin), increased skin pH, diet (fecal composition), age (urinary frequency), gestational age (inherent SC barrier maturation), use of antibiotic therapy, occurrence of diarrhea and underlying medical condition.[33,47-52] The SC is continuously exposed to transepidermal water owing to the occlusive nature of the diaper environment and from direct contact with urine. Increased SC hydration leads to maceration, disruption of the lipid bilayer structure, formation of amorphous intercellular regions and degradation of the corneodesmosomes.[53-55] Hydration causes corneocyte swelling, increases lipid membrane fluidity and enhances molecular transport, thereby increasing permeability to exogenous materials.[53,54] Hydrated skin has a higher frictional coefficient, thereby enhancing the effects of mechanical trauma.[56]
Diapered skin pH was higher than a nondiapered control site in newborns and older infants.[12] In vitro, increased pH was related to the effects of occlusion and increased skin permeability.[30] Higher skin pH was associated with increased skin hydration and higher diaper rash scores.[50] Higher pH may decrease SC integrity and increase susceptibility to mechanical damage in high risk infants.[57]
Irritant exposure significantly effects epidermal barrier structure and function, including SC lipid bilayer disruption, increased permeability and inflammation. A damaged barrier can allow penetration of irritants (e.g., enzymes and bile salts) into the viable epidermis. Irritants such as sodium lauryl sulfate and nonanoic acid increase keratinocyte proliferation and affect metabolism and differentiation.[58,59] In response to this, the epidermis rapidly initiates barrier repair (SC formation), resulting in a defective structure, aberrant water handling properties and inadequate desquamation.[60-65] Figure 2 illustrates some of the processes involved in irritant dermatitis. Figure 2. Добавлено (16.08.2009, 20:36)
---------------------------------------------
Impact of the diaper environment on the skin barrier. The features of the normal epidermal barrier and how various factors of the 'diaper environment' impact skin barrier structure, function and response are described. The humid environment leads to overhydration of the SC causing disruption of the lipid bilayer structure. When the SC integrity is damaged, irritants and microorganisms can penetrate and reach the Langerhans cells and epidermis. Fecal enzymes disrupt the SC integrity by degrading proteins, providing another mechanism for barrier breach. Premature infant skin has fewer SC layers and, therefore, increased permeability. Penetrants/irritants interact with keratinocytes stimulating them to release cytokines. Cytokines act on the vasculature of the dermis resulting in inflammation. SC: Stratum corneum. Perineal skin breakdown can occur in infants and older patients when pancreatic enzymes cannot be sufficiently deactivated in the colon.[66,67] Cumulative application of a mixture of chymotrypsin, elastase, lipase (pancreatic enzymes) and bile salts significantly increase erythema, blood flow, skin pH and TEWL under occlusive conditions.[68] Fecal protease activity is pH dependent and increases considerably from pH 5-6 with a maximum at pH 7.[33,48] For fecal lipase, skin pH has to be above 7 for significant changes in lipase activity to occur.[48] Bile salts can potentiate the activity of pancreatic lipases.[69] Patients receiving supplemental digestive enzymes for metabolic conditions are at risk for perineal skin breakdown because unabsorbed enzymes can be excreted in feces.[70] Infants with neonatal abstinence syndrome often have diarrhea and can have severe diaper skin excoriation.[71-73]
Candida infection is associated with diaper wearing, in part because moist environments support microbial growth.[32,35] Candida sp. was present at significantly higher frequencies in 48 infants with mild-moderate dermatitis versus 28 infants without rash.[74] Staphylococcus aureus was recovered from perineal and inguinal sites in both groups but was not correlated with skin breakdown. The increased Candida sp. was attributed to the skin breakdown (i.e., extent of colonization correlated with rash severity).[74] In 40 infants with diaper rash, the following were recovered: Candida sp. (65.7%), nonhemolytic Streptococcus (18.5%), Staphylococus epidermidis (19.2%), β-hemolytic Strep (12.8%) and α-hemolytic Strep (9.2%). Candidiasis was found in 54.3% of rash cases and was associated with cotton diapers plus plastic covers, a cow's milk diet (vs breast milk) and malnutrition.[75]
Dermatitis with brown coloration and xerosis, described as thin sheets of desquamating skin, was seen in the inguinal and gluteal regions in 15 infants and was attributed to frequent cleansing with an acidic liquid product.[76] A controlled comparison trial to confirm the cause was not conducted. We have observed similar xerosis, erythema and hydrated skin in the inguinal folds of premature infants. These areas do not contact the absorbent diaper and persistent hydration may be responsible for the xerosis and irritation. DD can also be due to the underlying medical condition and/or treatment. For example, skin rashes have been observed in patients with biotin deficiency.[70,77] A graft versus host disease with the characteristics of DD was reported in a bone marrow transplant patient.[78] Diaper Dermatitis in Adults
The information on DD comes from studies on infants and from simulations of the diaper environment using an adult forearm skin model. There are few reports on the etiology and severity among incontinent adults.[64,65] Skin repair is slower in aged skin (> 75 years) and the SC is less cohesive.[79] The skin pH is increased in subjects from 50 to 80 years of age owing to a reduction in Na+/H+ antiporter expression.[79] The increased pH reduces glucocerebrosidase activity, leading to negative effects on the barrier lipid processing system. Wound-healing rates are slower, inflammatory processes are less efficient and cell-mediated immunity is weakened in aged skin.[80]
The diaper skin condition was evaluated in parallel groups of incontinent (n = 30; 86.3 years; diaper wearing and bedridden) and continent (n = 29; 83.0 years; no diapers and ambulatory) patients who were matched for primary health conditions.[81] The skin from the perineum to the coccyx was evaluated for scars, postinflammatory hyperpigmentation, texture, hydration, pH and ceramides. A notable feature was the loss of skin texture and a glossy appearance among 70% of the incontinent group compared with the controls. The frequency of abnormal features and scarring was higher in the incontinent group. Skin hydration was significantly higher for the incontinent group. Skin pH and total ceramide levels were significantly higher for subjects with glossy skin compared with the controls and the incontinent patients with normal skin texture. The higher pH and ceramide levels were attributed to increased SC detachment.[81] TEWL was not measured, but the increased hydration may indicate a poorer SC barrier. Interestingly, 28% of the continent group had hyperpigmentation, a feature that may indicate previous episodes of epidermal inflammation. Yeast infections can occur among aged patients, including Candida albicans (e.g., groin) as can tinea of the vulvar skin folds and bacterial infections (e.g., necrotizing fasciitis, vulvar folliculitis and intertrigo).[82,83]
For older patients, diaper skin breakdown includes irritant dermatitis, skin tears and pressure ulcers.[84] DD increases the risk of developing pressure ulcers.[85,86] Prevention is a major focus of quality improvement efforts because of the substantial complications associated with pressure ulcers.[87] Treatment of Diaper Dermatitis
Overview Diaper dermatitis is often the persistent compromise of epidermal barrier.[88] DD may appear to be resolved, but barrier function often remains compromised at the microscopic level and the presence of minor skin damage increases the likelihood of further injury. Treatment strategies aim to minimize or eliminate the contributing factors and to detect compromise early. A treatment algorithm is shown in Box 1 . Specific modalities and the supporting evidence are described.
Once skin compromise is observed, the presence of infection must be determined. Rash due to C. albicans is characterized by bright red color, patchy pattern (areas may be surrounded by scales) and pustules. Treatment with antifungal agents is indicated and is described later. Specific treatment for bacterial dermatitis is based on the causative agent. The treatment goal is to facilitate healing and minimize further irritation. Recovery of skin barrier compromise occurs more rapidly with films, barriers or creams that are semipermeable to water vapor transport rather than with systems that are completely occlusive or completely open to air.[89,90] Hydration & Diapers. Reduction of diaper skin moisture is an essential component of treatment.[91] Infant diapering practices have evolved from the use of cloth (covered with plastic, impermeable over pants), to disposable diapers with a cellulose core and a plastic outer cover, to disposable diapers with highly absorbent polymers (known as absorbent gelling material and referred to as AGM diapers) and to AGM diapers with a permeable or 'breathable' outer cover.[30,92-94] Versions of AGM diapers have been made with skin protectants (petrolatum and zinc oxide) on the inner sheet for transfer to the skin. A comparison of the technologies showed that reusable cloth diapers absorb urine but generally do not reduce humidity or remove skin surface moisture, especially when used with plastic pants. Disposable diapers absorb urine/moisture, wick it away from the skin and prevent rewetting over time. The net effect is decreased humidity versus cloth. Disposable diapers with cellulose and AGM were compared with cloth in over 1600 subjects, including atopic infants.[51,95-98] Skin wetness was lower for disposable diapers versus cloth. AGMs consistently reduced wetness compared with other disposables and cloth. Rash scores were significantly lower for infants who wore AGM diapers. The skin pH was lower for AGMs than cellulose or cloth. It was nearly unchanged as a urine load increased versus certain cellulose diapers for which skin pH increased.[51] As the diaper technology has evolved, reports indicate that DD severity has decreased.[93,94] A 2006 Cochrane Review evaluated 17 of 28 published studies, found insufficient quantitative data for analysis and concluded that randomized, controlled studies were needed to support a particular diaper type for prevention of infant DD.[99] Recent studies demonstrated a decreased frequency of severe rash: cloth (60%), cellulose disposables (39%), AGM disposables (29%) and AGMs with a breathable outer cover (13%).[92,100] Moderate rash went from 35% with cloth to 53% for cellulose and 56% for AGM, reflecting reduction in severe cases. Moderate cases decreased to 32% for AGMs with breathable covers.[92] Severe DD, including rash with C. albicans, was reduced by 38-50% among infants in disposables with a breathable outer cover and the reduction was directly related to the technical breathability.[34] The breathable cover created conditions unfavorable to C. albicans survival.
The negative effects of moisture can be minimized with frequent diaper changes, especially in the newborn period. Some clinicians recommend changing the diaper every 2-4 h as low levels of moisture are sufficient to disrupt the SC barrier.[70,91,101-103] Leaving the skin undiapered when possible, drying the skin before applying a new diaper and using a hair dryer (no heat setting) to dry the skin are recommended.[101,104] Incontinence products with absorbent cores and breathable outer covers are marketed for adults.[163] Moisture management is essential owing to the increased risk for pressure ulcers among adults.[105,106]
Irritants & Friction. The treatment goal is to minimize chemical and mechanical irritants from urine, feces, products and cleansing practices.[100] An individualized plan should be formed based on bladder and bowel habits (frequency), skin condition, ability to self-manage (for adults) and medical conditions. The skin should be cleansed as soon as possible after soiling to minimize fecal exposure time.[70] Optimum cleansing systems maximize removal of skin contaminants, contain ingredients of low/no irritancy, minimize irritating residuals left on the skin, require minimal rubbing and use soft implements. Excessive rubbing and over cleaning can cause mechanical stripping and SC barrier damage.
Cleansing products typically contain surface active agents (surfactants) to emulsify soils. Surfactants vary in inherent skin irritancy as shown in Table 2 .[107,108] Since ingredients must be listed on the product label, the surfactants can be assessed for irritancy. Residual surfactant can remain on the skin, especially when copious rinsing is not practical.[109]
Diaper skin can be cleansed with a soft cloth and an oil-in-water lotion to assist in soil removal.[91] Wipes composed of a substrate with cleansing agents and/or emollients have been developed. In studies among healthy infants, cleansing with a diaper wipe resulted in significantly lower erythema and surface roughness versus water plus an implement (cotton washcloth and cotton wool balls).[110,111] The use of wipes composed of a soft nonwoven substrate-containing water, nonionic cleansers and emollients resulted in reduced skin irritation (erythema and rash) and TEWL versus cloth and water in premature and full-term neonatal intensive care unit (NICU) infants.[112,113] Products used on diapered skin should be free of volatile alcohol (ethyl and isopropyl), fragrance and ingredients of known irritancy and contain only essential materials.[114] Skin Infections. Topical nystatin, miconazole, clorimazole and ciclopirox are indicated for diaper candidiasis in infants.[115] Nystatin is prescribed most frequently by pediatricians.[37] Combinations of antifungals and mid-high potency corticosteroids (e.g., nystatin and triamcinolone, clotrimazole and β-methasone dipropionate) are not recommended owing to the skin atrophy from steroids and the ability of the occlusive environment to enhance penetration.[37] Treatment with ciclopirox provided a significant reduction in severity and an increase in cure rate among 48 infants (6-29 months). It is recommended because of additional (antibacterial and anti-inflammatory) effects.[116] In a placebo-controlled trial of subjects with acute DD, those treated with 0.25% miconazole nitrate in zinc oxide/petrolatum (n = 101) had significantly lower rash scores than the control group who received the zinc oxide/petrolatum vehicle (n = 101).[117] The greatest reductions were in subjects with moderate-severe rash and in those with candidiasis. A separate safety study found that the systemic absorption of miconazole nitrate was low in infants with DD.[118] Treatments for bacterial DD should be based on the organisms involved. Topical Treatment & Skin Products. Ideally, topical treatments:
• Provide a semipermeable 'film' or 'layer' over the damaged skin to facilitate SC barrier repair[89,90];
• Provide a physical shield between the skin and the irritants[33,48,49];
• Remain in place on the skin (not removed by feces);
• Maintain the acid mantle (acidic pH)[50];
• Allow for ease of cleansing the skin (minimize stripping). Diapers as Delivery Systems Disposable AGM diapers with materials on the inner sheet were introduced in the late 1990s. Over 24 h, 0.17 mg/cm2 of petrolatum could be delivered to the skin surface and healthy infants (n = 391; 8-24 months) wearing the treated diaper (containing petrolatum, stearyl alcohol and aloe) had significantly lower perineal and genital erythema scores than the control group (without inner sheet formulation).[119] An AGM with petrolatum, stearyl alcohol and zinc oxide was compared with an AGM control (no additives) in healthy infants (total n = 268; mean age: 9.9 months). The test subjects had significantly lower diaper rash scores (perineal, genital, buttocks and leg folds) than the control infants.[120] Lower rash severity was found for AGMs with petrolatum/zinc oxide versus petrolatum alone, but specific scores were not reported. Regulatory Guidance for Skin Products
Topical skin products include barrier creams, barriers, skin pastes, skin protectants, moisture barriers and moisturizers. Many are marketed under the US FDA final monograph entitled 'Skin Protectant Drug Products for Over-the-Counter Human Use' (21 Code of Federal Regulations Parts 310, 347 and 352).[121] Under this monograph, skin protectants 'provide temporary relief from harmful or annoying stimuli' and the allowed ingredients are listed in Table 3 . Those noted with (*) can also make the claim 'temporarily protects minor cuts, scrapes and burns'. Ingredients designated with (‡) can state 'helps prevent and temporarily protects and helps relieve chaffed, chapped or cracked skin' on the label.[121] Dimethicone is the only silicone allowed as a skin protectant. Lanolin must be combined with other protectants for use in diaper rash. Glycerin is an active ingredient at levels of 20-45%. Frequently, glycerin is present at lower levels and designed as inactive. Products are required to have these warnings: for external use only, do not use on deep puncture wounds, serious burns and animal bites, do not get into eyes, keep away from face and mouth to avoid breathing it, stop use or ask doctor if condition worsens or symptoms last more than 7 days or clear and return. Powders with Kaolin or starch are not to be used on broken skin.[121] Unlike prescription and certain over-the-counter drugs, the FDA does not require randomized, controlled clinical trials that demonstrate effectiveness of these products prior to their approval. Therefore, product users should not assume that they have been shown to be effective in adequate, controlled clinical trials. The listing of active ingredients may inadvertently convey efficacy versus other products or no treatment (placebo). The FDA does not review or approve cosmetic claims, such as 'soothes' or 'dryness'. Use of Topical Skin Products Active Ingredients. Topical products frequently contain zinc oxide, petrolatum and dimethicone individually or in combination as active ingredients. Reports on the treatment of irritant dermatitis with barrier creams have yielded mixed results, with skin improvement found in some studies and worsening shown in others.[122] The published research on the effects of skin protectants on DD is limited, particularly for adequately sized, randomized, controlled clinical trials among target populations. The limited data may be owing to the fact that products can be marketed without demonstrated efficacy. Hoggarth et al. evaluated six commercially available barrier products, each with a skin protectant as the active ingredient:
• Water-in-oil ointment (petrolatum);
• Ointment without water (dimethicone);
• Oil-in-water paste (zinc oxide);
• Oil-in-water lotion (dimethicone);
• Ointment base (zinc oxide);
• Oil-in-water lotion (dimethicone).[123] The three-part trial examined effectiveness against a model irritant (sodium lauryl sulfate [SLS]), protection from maceration and barrier to topical agents using a patch-test method among 18 adults. Products were applied for 15-20 min before the SLS-containing patch was placed at the site for 24 h (daily for 5 days). Zinc oxide was the most efficacious for irritant protection, petrolatum protected against irritants and maceration and silicone yielded good hydration. However, the test method (one application per day) differs from clinical practice where products are often applied several times in 24 h. Patches cause significant skin occlusion and are likely to facilitate penetration of the SLS irritant through the barrier treatment as well as the SC. Consequently, the method probably does not reflect the mechanism that occurs when the barrier treatment is applied to diapered skin. The study provides important data for the design of clinical trials among patients with infants and adults with compromised skin. Product Features. The product features of formulation type (how ingredients are put together) and manner of use in the clinical setting are important considerations. For example, product thickness and viscosity are controlled by the amount of water, lipid and particulate. Thicker products (pastes, creams and ointments) are usually water contained in oil emulsions with low water content or anhydrous. Pastes with powder are designed to absorb water, for example, for weeping wounds.[114] However, if the powder is within a hydrophobic material or lipid (e.g., zinc oxide powder in petrolatum), external water cannot be absorbed.[124] Pastes and petrolatum-based barriers can be very occlusive. Some clinicians recommend against their use for long periods or use them only in situations where soils (feces) are high in water and irritants.[114,124,125] There are no studies on the use petrolatum-based barriers to prevent DD in normal diapered skin.[114] Products that transfer from the skin to the diaper may interfere with the absorbance of skin moisture.[126,127] An increase in systemic candidiasis was found in extremely low birthweight infants (n = 40) who were treated with topical petrolatum.[128] It is possible that the applied amount was sufficiently occlusive to delay SC barrier development and/or to permit growth of coagulase negative staphylococcus.[65] Until the cause of the increased infection rates is understood, the use of petrolatum-based, low-water ointments in very premature infants will remain controversial. Other Topicals. A combination of zinc oxide and dexpanthenol in a vehicle (liquid paraffin and beeswax) was tested versus the vehicle alone in a paired comparison (one per side of diaper area) trial in 46 infants with diarrhea.[129] Dexpanthenol is absorbed and converts to pantothenic acid with known effects on epidermal repair. TEWL was significantly lower for the treatment at day 3, but no differences in diaper rash scores were observed. Zinc oxide (47%), eosin (2% solution) and a corticosteroid (clobetasone butyrate) were compared among 54 healthy infants with moderate-severe diaper rash and eosin provided the greatest improvement (vs baseline).[130] A total of 25 infants (1-48 months) with irritant dermatitis (20), atopic dermatitis (3), psoriasis (1) and streptococcal dermatitis (1) were treated with a barrier cream of zinc oxide, vitamin E and panthenol (alcohol form of pantothenic acid) for 14 days.[131] The candidiasis in 12 infants was treated simultaneously with a topical antifungal. Improvement reported as 'clinical healing' (13) or substantial reduction in dermatitis (9) was found in 21 infants. Studies to compare the formulation to a control are indicated.
A Cochrane Review examined the evidence on vitamin A (a component of the skin protectant cod liver oil, Table 3 ) for treatment and/or prevention of DD.[132] One study investigating 114 newborns reported no differences in DD for an ointment with vitamin A versus the vehicle. Significant improvement over 5 days was found in a preliminary trial in infants with moderate erythema with or without maceration who were treated with honey, olive oil and beeswax.[47] The number of candidiasis cases decreased from four to two. Demonstrated effectiveness of this treatment for other dermatoses (eczema, psoriasis and anal fissures) suggests that further evaluation for DD is warranted.[133]
A control of soap and water plus moisturizing lotion was compared with a no-rinse cleanser plus barrier cream for 3 weeks in adult incontinent (n = 32) by measures of skin condition, pain and time required by the nursing staff.[134] Mean scores decreased for the no rinse/barrier system and increased for the control (differences not significant, perhaps owing to the small sample size), skin condition was significantly correlated to pain and the time required was 41 min for the no rinse/barrier versus 120 min/day for the control. This study addresses the important issues of patient discomfort and staff time (directly tied to costs) and supports the importance of conducting larger scale trials. Special Situations. Patients with conditions that affect fecal composition (e.g., short bowel syndrome and cystic fibrosis) may benefit from formulations designed to mitigate the specific irritants. For example, cholestyramine forms a complex with bile acids to render them inactive. Topical preparations have been used successfully for severe perineal skin breakdown in infants with these diagnoses.[135-137] The cholestyramine in a suitable base can be prepared in hospital pharmacies. Similarly, sucralfate (Carafate) has been used (ointment and powder form) to treat perineal excoriation from gastric secretions.[138,139] Candidiasis in these patients must be treated with an antifungal.[138] Topical Films. The effectiveness of topical creams may be limited by poor substantivity and removal with diaper changes. Solutions and sprays that dry to form a semipermeable barrier film on the skin are available. They are intended to remain in place to protect the skin from direct irritant contact with irritants and to facilitate skin barrier repair. The films can minimize skin stripping from cleansing procedures. One example is Sureprep® No-Sting Protective Barrier Wipe (Sureprep NSPBW, Medline Industries, Inc., Mundelein, IL, USA). It is delivered to the skin from a water-based solution, is nonflammable and has no age restrictions for use. Another is Cavilon No-Sting Barrier Film (Cavilon NSBF, 3M Corporation, St Paul, MN, USA). It is delivered from a volatile silicone solvent to form the semipermeable film, is flammable, and can be use on infants older than 1 month (e.g., not for use on preterms). Cavilon NSBF was compared with zinc oxide oil in parallel groups (n = 20) of adult incontinent patients (76-92 years; mean: 4 years) with skin damage for 14 days.[126] The improvement in skin condition was significantly greater for Cavilon and it was more cost effective to use. Sureprep NSPBW was evaluated in a case report study among ten NICU infants with severe perineal skin breakdown.[140] Improvement in skin condition based on the area of involvement and severity was noted for eight patients (two were discharged and lost to follow-up). A trial of suitable size among parallel treatment groups is required to determine the effectiveness and the time course of improvement for Sureprep NSPBW relative to conventional barrier creams. Other Ingredients & Infants. Published research on the effects of the numerous products that adhere to, interact with or influence the skin barrier of infants is very limited. Products for the health and consumer skin care markets are typically tested on adults and/or rely on marketplace experience (lack of adverse effects) to support use on infants. They may contain ingredients that should be avoided, if possible, or used with caution.[141] For example, skin products containing boric acid are not recommended owing to its toxicity.[142,143] Benzalkonium chloride is used in skin products as a disinfectant or preservative and should be evaluated prior to use on infants. It has been implicated in allergic dermatitis in infants.[144] Future Perspective The following recent developments may be relevant for the treatment or prevention of DD over the next few years.
Sunflower Seed & Safflower Oils
Sunflower seed and safflower oils applied to the skin surface of premature infants have demonstrated reduction in nosocomial infections in developing countries.[145,146] Sunflower seed oil improved epidermal barrier function whereas the mustard oil commonly used for daily infant massage proved to cause damage.[147] Based on the mechanistic studies, the barrier effects of these oils may translate to the mitigation and treatment of irritant DD. Potato Tuber Protein
Ruseler-van Embden et al. have identified a protein in potato tuber that inhibited the proteolytic enzyme activity in feces as a method for reducing perineal excoriation and demonstrated proof of concept in a clinical study.[67] Vernix Caseosa
Films of vernix caseosa impeded exogenous chymotrypsin (found in meconium) penetration but retained endogenous enzyme (necessary for epidermal development) activity in vitro. [148] Treatment of superficial SC wounds (tape-stripped skin) with vernix facilitated barrier repair relative to controls.[149,150] In model systems, treatment with vernix enhanced SC formation without increasing epidermal thickness.[150] A synthetic vernix analogue with the high water content, slow water release and properties and semipermeability to water vapor of native vernix has been reported.[151] Stratum Corneum Ceramides Stratum corneum ceramides 1 and 3 have been effective in the restoration of barrier damage from SC tape stripping, SLS exposure and atopic dermatitis in laboratory and in vivo trials.[152-154] Product formulations with both ceramide 1 and 3 reduced TEWL and increased hydration over 4 weeks following irritant (SLS) exposure.[155] The effects of ceramide-containing products on irritant DD and chronic inflammation need further research and are certainly warranted. Management of Diaper Skin pH Reduction on diaper skin pH represents a potential strategy for improving skin condition. An acidic pH is necessary for the effective functioning of enzymes in SC formation and integrity, and contributes to the SC innate immune function by inhibiting colonization of pathogens (e.g., S. aureus).[4-6] The rate of barrier recovery increased following application of a pH 5.5 buffer.[7] Diaper wipes with pH buffers have been developed.[100] Treatment with a new diaper wipe resulted in significantly lower diaper skin pH than the hospital standard of cloth and water in a repeated-use trial among high-risk premature and full-term infants.[113] Incontinence Management Systems for managing incontinence offer another approach for improving diaper skin conditions. Use of a system including an adult brief (diaper) and two wipes for cleansing/protection in a waterproof pouch resulted in a greater frequency of using wipes for cleansing and decreased the time for care.[156] Use of a device for managing fecal incontinence (Flexi-Seal® Fecal Management System) maintained or improved skin condition in 92% of hospital patients and awaits further evaluation to document cost-effectiveness.[157] In Vivo Skin Assessment Methods New developments in noninvasive methods and instrumentation for the in vivo assessment of SC and epidermal function will contribute significantly to the fundamental understanding of the biological response in irritant dermatitis and, thereby, to the development of new treatments. As an example, in vivo confocal Raman microspectroscopy has been used to determine the penetration of topical oils and petrolatum in the SC.[158] Effects of Stress The role of the skin in the environment of care is highlighted by the field of neuroimmunology. For example, an infant perceives and reacts to care through the skin via receptors sensitive to mechanical stimuli and critical for survival. Signal transduction proteins have been identified.[159] Early development is stressful for the NICU patient. Psychological stress is associated with delayed skin barrier recovery attributed to increased glucocorticoid production.[160] Stress adversely effected differentiation, reduced epidermal cell proliferation and decreased corneodesmosome size and density, all of which negatively impact skin barrier function.[161] Stress decreased antimicrobial peptides and resulted in more severe skin infections.[162] Commentary
The causes of DD were described in well-founded research published in the 1980s and spurred the development of technology to increase absorbency and reduce skin hydration. Interest in reducing skin breakdown in clinical settings has stimulated the search for further improvements. Yet, there are relatively few randomized, controlled clinical trials among the most vulnerable populations, such as premature infants, infants with neonatal abstinence syndrome and incontinent adults. Substantial data from adequately sized controlled trials are required to guide clinical practice and improve outcomes. There is a need to implement objective, quantitative methods for evaluating skin condition. The paucity of research literature may be related to the fact that topical skin products are not required to demonstrate clinical effectiveness as protectants in order to receive approval for sale. One challenge is identifying sources of funding for the work (i.e., healthcare institutions, governments and/or for profit industries). New policies indicate that federal agencies (e.g., Centers for Medicare and Medicaid Services) will not reimburse institutions for treatment of facility acquired conditions such as pressure ulcers. Perhaps, initiatives to reduce skin breakdown will follow. Coordinated efforts among clinicians, researchers and administrators to provide quality improvements have been successful. The approaches are well suited for initiatives to significantly reduce common irritant dermatoses.
Сообщение отредактировал vachib - Воскресенье, 16.08.2009, 20:29 |
| |
| |
| Наталья |
Дата: Воскресенье, 16.08.2009, 20:43 | Сообщение # 2 |

Группа: Администраторы
Сообщений: 229
Статус: Offline |
Современное представление о пеленочном дерматите: этиология и лечение
Резюме и введение Резюме Пеленочный дерматит - очень распространенное состояние, которое причиняет дискомфорт и стресс для пациентов и неудовлетворенность медицинским обслуживанием. Технологии производства подгузников развиваются, чтобы существенно уменьшить выраженность пеленочного дерматита, но необходимы дополнительные усовершенствования. Недоношенные младенцы и взрослые с недержанием мочи и кала особенно опасны для развития пеленочного дерматита и его потенциальных последствий. Провоцирующие факторы включают гипергидратацию, раздражение, трение, увеличение pH кожи, диету, гестационный возраст, использование антибиотиков, диарею и состояние здоровья. Лечение стремится уменьшить гидратацию, обеспечить полупроницаемый слой, чтобы облегчить восстановление кожного барьера, оградить кожу от раздражителей, дезактивировать специфические фекальные компоненты и поддерживать поверхность кожи. Изданные исследования относительно эффектов лечения пеленочных дерматитов особенно редки. Необходимы контролируемые клинические исследования, чтобы обеспечить окончательную ясность в выборе эффективного лечения. Эта статья обсуждает заболеваемость и этиологию пеленочного дерматита у младенцев и взрослых. Она обеспечит научную базу для репарации поврежденного кожного барьера и описывает недавние разработки, которые будут доступны в будущем. Введение Обращаясь к пеленочному дерматиту (ПД), мы охватываем самые современные представления о структуре, функции и эволюции кожи, основываясь на том, что кожа – пограничная среда для первичного ухода при любом взаимодействии с пациентом. Нормальная физиология кожи Человеческая кожа - очень динамический пограничный слой, который защищает организм с помощью различных механизмов. Она обеспечивает врожденный иммунитет, функционируя как физический барьер и предохраняет от вторжения патогенных микроорганизмов. Роговой слой препятствует потере воды внутренними органами и внешним раздражителям, генерирует кислотную мантию и обеспечивает антиоксидантную защиту. Жизнеспособный эпидермис непрерывно возобновляет роговой слой, защищающий против УФО повреждения, регулирующий температуру, участвующий в сенсорной трансдукции, обеспечивающий тактильную чувствительность и сопротивляющийся механическому повреждению. Эпидермис имеет резервные механизмы, которые немедленно начинают репарацию ткани в случае травмирования кожи. Кислая pH рогового слоя необходима для действия ферментов, участвующих в формированием и сохранности рогового слоя (то есть, метаболизма липидов, двухслойной структуры, синтеза керамидов, межмолекулярных клеточных связей и десквамации). Восстановление барьера после ранения может быть ускорено применением кислого буфера (pH 5.5). Кислая pH вносит вклад в функцию врожденного иммунитета, ингибируя колонизацию патогенов. Эволюция эпидермального барьера Доношенный новорождённый имеет при рождении хорошо развитый и эффективный эпидермальный барьер, несмотря на воздействие водной и амниотической жидкости в течение 9 месяцев. При рождении, кожа новорожденного обеспечивает тепловую регуляцию, препятствует потере воды и химическому воздействию, обеспечивает тактильную чувствительность, контроль инфекций, иммунный надзор, антиоксидацию и формирование кислотной мантии. Трансэпидермальная потеря воды равна или ниже чем у взрослых и указывает на очень компетентный барьер. Гидратация кожи быстро снижается и затем увеличивается в течение первых двух послеродовых недель, указывая на адаптивные изменения в роговом слое. Увеличивающаяся гидратация объясняется изменением свойств рогового слоя. Уровни водо-растворимых аминокислот (то есть, естественного фактора увлажнения), в роговом слое доношенных младенцев полного были чрезвычайно низки. Возможно, он экстрагируется в амниотическую жидкость. Кроме того, протеолиз филагрина, который производит естественный фактор увлажнения, может действовать как часть адаптации к сухим окружающим условиям. Поверхность кожи pH нейтральна при рождении, значительно уменьшаясь в течение первых 1-4 дней и продолжает понижаться в течение первых 3 месяцев у доношенных младенцев. Роговой слой новорожденного содержит активные иммунные белки (лизозим и лактоферрин). Концентрации лизозима и активность мирамидазы были в пять раз выше у новорождённых и не изменялись при обычном купании.
Обычно, длительный контакт с водой приводит к мацерации кожи, разрушению барьера и последующей травматизации эпидермиса, поднимая вопрос о том, как младенец развивает превосходный барьер во время нахождения в воде. Считают, что первородная смазка играет существенную роль в развитии барьера. Первородная смазка - сложная смесь 80% воды, 10% белка и 10% липидов с корнеоцитами, встроенными в липидный матрикс, которая покрывает кожу от головы до ног в течение последнего триместра. Необыкновенно много воды связано с клетками. Считается, что формирование, первородной смазки находится под гормональным контролем за счет липидов, генерируемых клетками сальных желез в волосяных фолликулах. Они вытесняются на область межфолликулярного эпидермиса, чтобы охватить всю поверхность. По-видимому, первородная смазка формирует гидрофобный слой, чтобы защитить эпидермис от воздействия воды и создать благоприятные условия для кератинизации и формирования рогового слоя. Первородная смазка содержит антибактериальные вещества (например, лизозим и дефензины), которые эффективны против определенных микроорганизмов. В параллельных группах новорожденных, сохранение первородной смазки привело к значительно более высокой гидратации кожи с течение 24 часов после рождения по сравнению с ее удалением. Значение pH кожи было более низким, позволяя предложить, что первородная смазка облегчает развитие кислотной мантии. В целом, первородная смазка играет роль в развитии барьерной функции рогового слоя за счет разнообразных защитных и адаптивных механизмов. ВОЗ рекомендует подождать по крайней мере 6 часов до купания новорожденных младенцев. Пациенты высокого риска: кожа недоношенных младенцев Недоношенный младенец имеет плохо сформированный барьер с небольшим количеством ороговевающих слоев. У младенцев 24-25 недель гестации созревание барьера произошло, но трансэпидермальная потеря воды была все еще значительно выше в 1 месяц, по сравнению с доношенными младенцами. Недоношенные новорождённые, родившиеся ранее 28 недель испытывают недостаток в покрытии первородной смазкой. Время полного созревания барьера изменяется с 2 до 9 недель послеродового возраста. Влажность окружающей среды влияет на развитие барьера. Воздействие 10% относительной влажности продемонстрировало уменьшение гидратации кожи, но увеличило эпидермальный синтез ДНК, это наводит на мысль, что низкая гидратация может вызывать пролиферацию клеток. Ненормальная десквамация часто наблюдается в течение нескольких недель у сильно недоношенных младенцах. Влажность также воздействует на протеолиз эпидермального филаггрина в водо-растворимых аминокислотах, которые облегчают связывание воды роговым слоем. При рождении, протеолиз (на модели животных) происходит при влажности 80-95 %, но не при более высокой или низкой влажности, это предполагает, что генерация водо-растворимых аминокислот зависит от окружающей влажности. Без адекватного уровня водо-растворимых аминокислот, роговой слой сух, имеет низкую способность к удерживанию воды и не производит десквамацию должным образом. Вероятно уровень водо-растворимых аминокислот будут очень низким при условиях быстрого развития рогового слоя в случае преждевременных родов. pH кожи уменьшено в течение 4 недель после рождения у младенцев с очень низким весом при рождении, меняется с гестационным возрастом и было выше в течение более длительного периода у младенцев весом менее 1000 г. Время завершения развития кислотной мантии может быть более длительным у недоношенных младенцев, чем у доношенных. В течение развития барьера, у недоношенного младенца существует опасность повышенной проницаемости для экзогенных агентов и повреждения кожи. Заболеваемость пеленочным дерматитом Пеленочный дерматит - очень распространенное состояние, которое может причинить дискомфорт и стресс для пациентов и вызвать неудовлетворенность медицинским обслуживанием. Раздражительный пеленочный дерматит - результат нарушения барьера, характеризуется сухостью, измененной десквамацией и эритемой (Фото 1). Более серьезные случаи проявляется высыпаниями, папулами, пузырьками, более интенсивной эритемой и изъязвлениями (экскориациями). Была разработана степень выраженности, чтобы отразить этиологию раздражения кожи и базируется на степени и области повреждения. 0-4 степень охватывает целостность кожи (шелушение и изъязвление), эритему (пятнистая, непрерывная) и высыпания (папулы, пузырьки и отёк), и делится на очень легкую, легкую, умеренную, умеренно-тяжелую и тяжелую (Таблица 1). Исключая атопический дерматит, псориаз и себорейный дерматит, раздражительный пеленочный дерматит включает генерализованный раздражительный контактный дерматит, милиариа, опрелость и кандидоз. 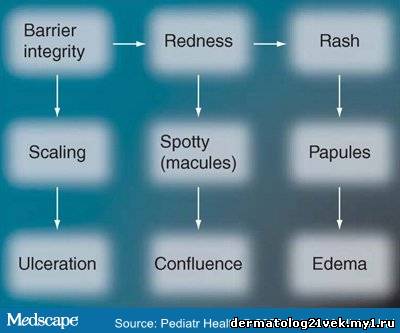 Фото 1. Обычная последовательность, ведущая к раздражительному пеленочному дерматиту. Начальные изменения включают компромисс целостность барьера рогового слоя. Как только барьер поврежден, химическое и/или механическое раздражение вызывает воспаление (эритему). Длительное раздражение может привести к экскориациям, высыпаниям и отекам. В исследовании 1089 младенцев, половина имела видимый пеленочный дерматит, проявляющийся сухостью и/или эритемой, а 5 % имели серьезные повреждения. Приблизительно половина (53  использовали исключительно одноразовые подгузники, 43 % использовали и тканевые и одноразовые подгузники и 4 % использовали исключительно тканевые. Из 1500 младенцев, которые использовали одноразовые подгузники со впитывающим полимерным гелем, 33 % имели умеренный дерматит и 2-6 % имели серьезные случаи. Проводился обзор 1773 пациентов детской больницы, чтобы определить характеристики пеленочного дерматита среди типичных пациентов. Высыпания в промежности - самый частый тип (73 %), сыпь в промежности или общей области (17 %), сыпь с перианальными узелками (4.5 %), псориазиподобная сыпь (1.7 использовали исключительно одноразовые подгузники, 43 % использовали и тканевые и одноразовые подгузники и 4 % использовали исключительно тканевые. Из 1500 младенцев, которые использовали одноразовые подгузники со впитывающим полимерным гелем, 33 % имели умеренный дерматит и 2-6 % имели серьезные случаи. Проводился обзор 1773 пациентов детской больницы, чтобы определить характеристики пеленочного дерматита среди типичных пациентов. Высыпания в промежности - самый частый тип (73 %), сыпь в промежности или общей области (17 %), сыпь с перианальными узелками (4.5 %), псориазиподобная сыпь (1.7  и частичные высыпания младенческого дерматита (1.5 %). Однако, о типах пеленочного дерматита не сообщалось. Матери 12 103 младенцев провели анкетирование относительно пеленочного дерматита и 25 % их младенцев имели умеренную, выраженную или очень выраженную пеленочную сыпь. 34 % из общего количества использовали только тканевые подгузники, 25 % использовали исключительно одноразовые подгузники и 33 % использовали смешанные типы подгузников. Педиатрические кабинеты сообщили об 1 миллионе случаев амбулаторных посещений в год с пеленочным дерматитом (также включая баланиты, вульвовагиниты, опрелости и кандидоз). Специфические методы пеленания (например, тип подгузников и лечение сыпи) не были обеспечены. Среди 532 недоношенных младенцев до 24 месяцев с одного участка (83 % госпитализированных, 17% амбулаторных) определили пеленочный дерматит как сыпь, которую родители связывали с ношением подгузников и 52 % имело по крайней мере один случай. Из общего количества младенцев, 15 % имели три или больше случаев появления сыпи, а 99 % младенцев использовали одноразовые подгузники. 1-дневная оценка 283 младенцев (от 7 месяцев до 11 годам) в педиатрической клинике продемонстрировала, что у 60 % имелось недержание мочи. Пеленочный дерматит был установлен у 16 % и 12 % из них имели кандидоз, 63 % имели неповрежденный эпидермис и 25 % имели высокий риск (поврежденный эпидермис). Тип подгузников не определялся. Среди 1064 стационарных больных (до 17 лет) в девяти американских детских больницах, частота кожных нарушений (исключая пролежни) составляла 14.8 % и риск пеленочного дерматита был установлен в 42 % случаев. О деталях относительно типа подгузников и лечения сыпи не сообщалось. Пеленочный дерматит не присутствовал при рождении у 31 здоровых доношенных новорождённых, но к 14 дню 90 % имели риск повреждения кожи, особенно в анальной/перианальной области. Через 1 месяц 29 % имели сыпь (папулы). Один и тот же тип одноразовых подгузников использовался всеми субъектами. и частичные высыпания младенческого дерматита (1.5 %). Однако, о типах пеленочного дерматита не сообщалось. Матери 12 103 младенцев провели анкетирование относительно пеленочного дерматита и 25 % их младенцев имели умеренную, выраженную или очень выраженную пеленочную сыпь. 34 % из общего количества использовали только тканевые подгузники, 25 % использовали исключительно одноразовые подгузники и 33 % использовали смешанные типы подгузников. Педиатрические кабинеты сообщили об 1 миллионе случаев амбулаторных посещений в год с пеленочным дерматитом (также включая баланиты, вульвовагиниты, опрелости и кандидоз). Специфические методы пеленания (например, тип подгузников и лечение сыпи) не были обеспечены. Среди 532 недоношенных младенцев до 24 месяцев с одного участка (83 % госпитализированных, 17% амбулаторных) определили пеленочный дерматит как сыпь, которую родители связывали с ношением подгузников и 52 % имело по крайней мере один случай. Из общего количества младенцев, 15 % имели три или больше случаев появления сыпи, а 99 % младенцев использовали одноразовые подгузники. 1-дневная оценка 283 младенцев (от 7 месяцев до 11 годам) в педиатрической клинике продемонстрировала, что у 60 % имелось недержание мочи. Пеленочный дерматит был установлен у 16 % и 12 % из них имели кандидоз, 63 % имели неповрежденный эпидермис и 25 % имели высокий риск (поврежденный эпидермис). Тип подгузников не определялся. Среди 1064 стационарных больных (до 17 лет) в девяти американских детских больницах, частота кожных нарушений (исключая пролежни) составляла 14.8 % и риск пеленочного дерматита был установлен в 42 % случаев. О деталях относительно типа подгузников и лечения сыпи не сообщалось. Пеленочный дерматит не присутствовал при рождении у 31 здоровых доношенных новорождённых, но к 14 дню 90 % имели риск повреждения кожи, особенно в анальной/перианальной области. Через 1 месяц 29 % имели сыпь (папулы). Один и тот же тип одноразовых подгузников использовался всеми субъектами.
Изданная литература по заболеваемости и серьезности пеленочного дерматита у пациентов домов престарелых ограничена. По крайней мере 50 % представителей имеют недержание. Среди 1918 представителей (16 учереждений в 15 штатах), 63 % имели недержание и 3.5 % имели легкий (легкая краснота, неповрежденная кожа и небольшой дискомфорт), умеренный (средняя краснота, кожа шелушится/отслаивается, небольшие области нарушенной кожи или маленьких пузырьков) или выраженный (интенсивная краснота, сыпь, более глубокое шелушение кожи или эрозии, большие пузыри или мокнутие, боль) дерматит. Среди 46 пациентов были раздражительный дерматит (16 %), кандидоз (63 %), экзема (11  и псориаз (11 %). Приблизительно 75 % пожилых, носящих подгузники 50 % имеют легкий дерматит, 20% умеренный и 5% тяжелый. Шнелль определил частоту мацерации, сухости/шелушения, высыпаний (папулы), отёка, пятен и эритемы в области подгузника у 100 пациентов дома престарелых, имеющих недержание (87.3 ± 8.0 лет). Отечная эритема была самым частым признаком, обнаруженным у 94 % пациентов. Влажность кожи была наиболее высока в задней части промежности. и псориаз (11 %). Приблизительно 75 % пожилых, носящих подгузники 50 % имеют легкий дерматит, 20% умеренный и 5% тяжелый. Шнелль определил частоту мацерации, сухости/шелушения, высыпаний (папулы), отёка, пятен и эритемы в области подгузника у 100 пациентов дома престарелых, имеющих недержание (87.3 ± 8.0 лет). Отечная эритема была самым частым признаком, обнаруженным у 94 % пациентов. Влажность кожи была наиболее высока в задней части промежности.
В заключение, пеленочный дерматит – частое состояние, хотя частота, о которой сообщается, изменяется в зависимости от определенных методологий. Определению тяжести пеленочного дерматита препятствует недостаток стандартизации определения и использования различных схем аттестации и инструментов оценки. Несмотря на эти ограничения, большинство случаев пеленочной сыпи попадает в категорию раздражительного контактного дерматита. Этиология пеленочного дерматита Несколько особенностей использования подгузничной ткани предрасполагают к повреждению кожи. Они включают гипергидратацию, контакт с раздражителями кожи (например, мочой, фекалиями, содеращими ферменты и соли желчи), механическое трение (ткани подгузника с кожей и кожи с кожей), повышенная pH кожи, диету (фекальный состав), возраст (частота мочеиспусканий), гестационный возраст (формирование барьера рогового слоя), лечение антибиотиками, возникновение диареи и основное медицинское состояние. Роговой слой непрерывно подвергается трансдермальной воде вследствие окклюзионного характера подгузничной ткани и прямого контакта с мочой. Повышенная гидратация рогового слоя ведет к мацерации, разрушению структуры двойного липидного слоя, формированию аморфных межклеточных областей и деградации корнеодесмосом. Гидратация вызывает набухание корнеоцитов, увеличивает текучесть липидной мембраны и увеличивает молекулярную транспортировку), таким образом увеличивая проницаемость для экзогенных материалов. Гидратированная кожа имеет более высокий фрикционный коэффициент, таким образом увеличивая эффект механической травмы.
Спеленутая кожа имеет более высокую pH, чем неспеленутый контрольный участок у новорожденных и более старших младенцев. In vitro, увеличение pH было связано с окклюзионым эффектом и увеличенной проходимостью кожи. Более высокая pH кожи была связана с увеличенной гидратацией кожи и более частой пеленочной сыпью. Высокий показатель pH может уменьшить целостность рогового слоя и увеличить восприимчивость к механическому повреждению у младенцев высокого риска.
Раздражающее воздействие значительно нарушает структуру и барьерную функцию эпидермиса и, включая разрушение двойного липидного слоя липида , увеличивает проницаемость и воспаление. Поврежденный барьер может усилить проникновение раздражителей (например, ферментов и солей желчных кислот) в жизнеспособный эпидермис. Раздражители типа лаурилсульфата натрия и неанионные кислоты увеличивают пролиферацию кератиноцитов и влияют на метаболизм и дифференцирование. В ответ на это, эпидермис быстро начинает репарацию барьера (формирование рогового слоя), приводя к дефектной структуре, нарушению водного обмена и неадекватной десквамации. Фото 2 иллюстрирует некоторые из процессов, вовлеченных в контактный дерматит. 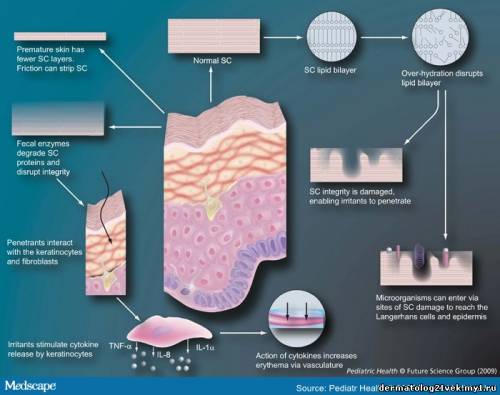 Фото 2.
|
| |
| |
| Наталья |
Дата: Воскресенье, 16.08.2009, 20:44 | Сообщение # 3 |

Группа: Администраторы
Сообщений: 229
Статус: Offline |
Воздействие подгузничной ткани на барьер кожи. Описаны особенности нормального эпидермального барьера и как различные факторы подгузничной ткани воздействуют на структуру, функцию и ответ кожного барьера. Влажная окружающая среда ведет к гипергидратации рогового слоя, порождая разрушение структуры двойного липидного слоя. Когда целостность рогового слоя повреждена, раздражители и микроорганизмы могут проникнуть через него и достигнуть клеток Лангерганса и эпидермиса. Фекальные ферменты разрушают целостность рогового слоя, вызывая деградацию белков, обеспечивая другой механизм нарушения барьера. Кожа недоношенных младенцев кожа имеет меньше слоев рогового слоя и, поэтому, повышенную проходимость. Пенетранты/ирританты взаимодействуют с кератиноцитами, стимулируя выброс ими цитокином. Цитокины действуют на сосуды дермы, приводя к воспалению. Нарушение кожи промежности может произойти у младенцев и старших пациентов, когда панкреатические ферменты не могут быть достаточно дезактивированы в толстой кишке. Совокупное применение смеси химопсина, эластазы, липазы (панкреатические ферменты) и солей желчных кислот значительно увеличивает эритему, кровоток, pH кожи и трансдермальную потерю воды при окклюзионном состоянии. Активность фекальной протеазы зависит от pH и значительно увеличивается с pH 5-6 до максимума pH 7. Для существенных изменений активности фекальной липазы pH кожи должна быть более 7. Соли желчных кислот могут потенцировать деятельность панкреатических липаз. Пациенты, получающие дополнительные пищеварительные ферменты при метаболических состояниях опасны для повреждения кожи промежности, потому что непоглощенные ферменты могут быть экскретированы в фекалии. Младенцы с неонатальным абстинентным синдромом часто имеют диарею и могут иметь выраженную травматизацию кожи, соприкасающейся с подгузником. Кандидозная инфекция связана с ношением подгузников, частично потому что влажная окружающая среда поддерживают микробный рост. Candida sp присутствовала в значительно более чаще у 48 младенцев с умеренным дерматитом против 28 младенцев без сыпи. Staphylococcus aureus был выделен в области промежности и паховых складок в обеих группах, но не коррелировал с повреждением кожи. Увеличение Candida sp было приписано повреждению кожи (то есть, степень колонизации коррелировала с выраженностью сыпи). У 40 младенцев с пеленочной сыпью было установлено следующее: Candida sp (65.7 %), негемолитический стрептококк (18.5 %), Staphylococus epidermidis (19.2 %), β-гемолитический стрептококк (12.8  и α-гемолитический стрептококк (9.2 %). Кандидоз был обнаружен в 54.3 % случаев сыпи и был связан с хлопковыми подгузниками с синтетическим покрытием, диетой с коровьим молоком (против грудного молока) и недоеданием. и α-гемолитический стрептококк (9.2 %). Кандидоз был обнаружен в 54.3 % случаев сыпи и был связан с хлопковыми подгузниками с синтетическим покрытием, диетой с коровьим молоком (против грудного молока) и недоеданием.
Дерматит с коричневой окраской и ксероз, описанный как тонкие пласты отшелушивающейся кожи, был обнаружен в паховых и ягодичных областях у 15 младенцев и был приписан частой очистке кислым лосьоном. Контролируемое сравнительное исследование для подтверждения причины не проводилось. Мы наблюдали подобный ксероз, эритему и гидратированную кожу в паховых складках недоношенных младенцев. Эти области не входят в контакт с подгузником и постоянная гидратация может быть ответственна за ксероз и раздражение. Пеленочный дерматит может также произойти из-за основного медицинского состояния и/или лечения. Например, сыпь кожи была обнаружена у пациентов с дефицитом биотина. О реакции «трансплантант против хозяина» с признаками пеленочного дерматита сообщалось у пациента с пересадкой костного мозга. Пеленочный дерматит у взрослых Информация относительно пеленочного дерматита прибывает от исследования младенцев и от моделирования пеленочного дерматита, используя модель кожи предплечья взрослого. Есть несколько сообщений относительно этиологии и тяжести среди взрослых, имеющих недержание. Восстановление кожи с возрастом замедляется (>, 75 лет) и роговой слой менее прочен. pH кожи увеличивается у субъектов от 50 до 80 лет вследствие уменьшения Na +/H + взаимодействия. Увеличение pH уменьшает активность глюкоцеребролидазы, приводя к отрицательным эффектам на систему обработки липидного барьера. Излечение ран замедленно, воспалительные процессы менее эффективны и клеточный иммунитет ослаблен в возрастной коже. Состояние кожи, соприкасающейся с подгузником было оценено в параллельных группах, страдающих недержанием (n = 30; 86.3 лет; носящие подгузники и прикованные к постели) и у пациентов (n = 29; 83.0 года; не носящих подгузники и способных к передвижению), которые соответствовали первичному состоянию здоровья. Кожа от промежности до копчика была оценена в отношении шрамов, поствоспалительной гиперпигментации, структуры, гидратации, pH и церамидов. Была установлена потеря структуры кожи среди 70 % группы, имеющих недержание по сравнению с контролем. Частота нарушений и рубцевания была выше в группе, страдающих недержанием. Также была значительно выше гидратация кожи. pH кожи и общее количество уровня церамидов была значительно выше у пациентов с нормальной кожей по сравнению с контролем и пациентов с недержанием по сравнению с нормальной структурой кожи. Повышение pH и уровня церамидов были приписаны повышению разъединения рогового слоя. Трансдермальная потеря воды не был измерена, но увеличенние гидратации может указать на более слабый барьер рогового слоя. Интересно, 28 % контрольной группы имели гиперпигментацию, особенность, которая может указать на предыдущие эпизоды воспаления эпидермиса. Дрожжевая инфекция могут возникать среди пожилых пациентов, включая Candida albicans (например, в паховой области), а также может возникать грибковое поражение кожных складок и бактериальная инфекция (например, некротический фасциит, фолликулит вульвы и опрелости).
У пожилих пациентов повреждение кожи подгузничной тканью включает раздражительный дерматит, мокнутие кожи и пролежни. Пеленочный дерматит увеличивает риск развития пролежней. Профилактика – главное условие предотвращения тяжелых осложнений, связанных с пролежнями. Лечение пеленочного дерматита Краткий обзор Пеленочный дерматит - частое персистентное повреждение эпидермального барьера. Может казаться, что пеленочный дерматит разрешился, но барьерная функция часто остается измененной на микроскопическом уровне и присутствие незначительного повреждения кожи увеличивает вероятность дальнейшей травматизации. Стратегии лечения стремятся минимизировать или устранить провоцирующие факторы и обнаруживать ранние признаки нарушения.
Как только обнаружено повреждение кожи, должно быть определено присутствие инфекции. Сыпь из-за C. albicans характеризуется ярко красным цветным, неоднородными краями (области могут быть окружены чешуйками) и пустулами. Лечение противогрибковыми препаратами описано позже. Специфическое лечение бактериального дерматита базируется на возбудителе. Цель лечения состоит в том, чтобы облегчить заживление и минимизировать дальнейшее раздражение. Восстановление барьера кожи происходит более быстро с пленками, или кремом, которые являются полупроницаемыми для воды, а не системами, которые являются полностью окклюзионными или полностью воздухопроницаемыми. Гидратация и подгузники. Уменьшение влажности подгузничной ткани - существенный компонент лечения. Методы пеленания младенцев развивались от использования тканных (синтетических, непроницаемых штанов), к одноразовым подгузникам с целлюлозной основой и синтетическим внешним покрытием, к одноразовым подгузникам с высоко впитывающими полимерами (известный как абсорбирующий желатинирующий материал и упомянули как AGM подгузники) и к AGM подгузникам с негерметичным или «воздухопроницаемым» внешним покрытием. Версии AGM подгузников были сделаны с защитными средствами для кожи (вазелин и окись цинка) на внутренней поверхности, соприкасающейся с кожей. Сравнение технологий показало, что тканные подгузники многократного использования поглощают мочу, но не уменьшают влажность поверхности кожи, особенно когда используется с синтетическими штанами. Одноразовые подгузники поглощают мочу/влагу, находятся далеко от кожи и предотвращают повторное увлажнение через какое-то время. Одноразовые подгузники с целлюлозой и AGM были сравнены с тканными у более чем 1600 пациентов, включая атопических младенцев. Влажность кожи была ниже при использовании одноразовых подгузников против тканных. AGM подгузники имели еще более меньшую влажность по сравнению с другими одноразовыми и тканными подгузниками. Различные высыпания были значительно ниже у младенцев, которые носили AGM подгузники. pH кожи была ниже при ношении AGM подгузников, чем целлюлозных или тканных. Она была почти неизменна, поскольку объем впитываемой мочи увеличился против некоторых целлюлозных подгузников, при которых pH кожи увеличилась. Поскольку технологии производства подгузников развились, сообщения указывают, что тяжесть пеленочного дерматита уменьшилась. В 2006 Кокрейн проанализировал 17 из 28 изданных исследований и нашел недостаточные количественные данные для анализа и заключил, что необходимы рандомизированные управляемые исследования, чтобы разработать специфический тип подгузников для предотвращения младенческого пеленочного дерматита. Недавние исследования продемонстрировали уменьшение частоты тяжелых форм сыпи: тканные (60 %), одноразовые целлюлозные (39 %), одноразовые AGM (29  и AGM с воздухопроницаемым внешним покрытием (13 %). Умеренная сыпь была в 35 % при тканных, в 53 % целлюлозных и 56 % AGM подгузниках, отражая сокращение тяжелых случаев. Умеренные случаи уменьшились до 32 % для AGM подгузников с воздухопроницаемыми покрытиями. Тяжелый пеленочный дерматит, включая сыпь с C. albicans, уменьшился на 38-50 % среди младенцев, использовавших одноразовые подгузники с воздухопроницаемым внешним покрытием и сокращение было непосредственно связано с технической пригодностью для дыхания. Воздухопроницаемое покрытие создавало условия, неблагоприятные для выживания C. albicans. и AGM с воздухопроницаемым внешним покрытием (13 %). Умеренная сыпь была в 35 % при тканных, в 53 % целлюлозных и 56 % AGM подгузниках, отражая сокращение тяжелых случаев. Умеренные случаи уменьшились до 32 % для AGM подгузников с воздухопроницаемыми покрытиями. Тяжелый пеленочный дерматит, включая сыпь с C. albicans, уменьшился на 38-50 % среди младенцев, использовавших одноразовые подгузники с воздухопроницаемым внешним покрытием и сокращение было непосредственно связано с технической пригодностью для дыхания. Воздухопроницаемое покрытие создавало условия, неблагоприятные для выживания C. albicans.
Отрицательные эффекты влажности могут быть минимизированы при частой замене подгузников, особенно в новорожденный период. Некоторые клиницисты рекомендуют замену подгузников каждые 2-4 часа, так как низкий уровень влажности достаточен, чтобы нарушить барьер рогового слоя. Рекомендуется по-возможности избегать пеленания, высушивание кожи перед применением нового подгузника и использование фена (установленного на невысокой температуре), чтобы высушить кожу. Изделия со впитывающей основой и воздухопроницаемым внешним покрытием производится и для взрослых. Уменьшение влажности кожи важно из-за повышенного риска развития пролежней у взрослых. Раздражители и трение. Цель лечения состоит в том, чтобы минимизировать химические и механические раздражители, содержащиеся в моче, фекалиях, с помощью изделий и методов очистки. Должен быть сформирован индивидуализированный план, основанный на чачтоте мочеиспускания и опорожнения кишечника, состоянии кожи, способности к самообслуживанию (для взрослых) и медицинских состояний. Кожу нужно очищать как можно скорее после загрязнения, чтобы минимизировать время контакта с фекалиями. Системы оптимальной очистки максимально удаляют загрязнение кожи, содержат нераздражающие компоненты, требуют минимальной протирки и используют мягкие средства. Чрезмерная протирка при очистке может причинить механический повреждение барьера рогового слоя.
Очищающие изделия обычно содержат поверхностно активные агенты (сурфактанты), чтобы эмульгировать загрязнения. Сурфактанты варьируют по раздражающим кожу свойствам как показано в Таблице 2 . Так как компоненты должны быть внесены в список на этикетке изделия, сурфактанты могут быть оценены по степени раздражения. Остатки сурфактанта могут остаться на коже, особенно когда практикуется недостаточно обильное ополаскивание.
Кожу под подгузником можно очищать мягкой тканью и лосьоном типа масла в воде для удаления загрязнений. Были разработаны влажные салфетки, содержащие очищающие агенты и/или эмольянты. В исследовании здоровых младенцев, которых обрабатывали очищающими салфетками было указано на значительно более низкую частоту эритемы и поверхностного огрубения против гигоскопических средств (хлопковые салфетки и ватные шарики). Использование салфеток из мягких нетканых содержащих водный субстрат, неионные моющие средства и эмольянты привело к уменьшению раздражения кожи (эритема и сыпь) и трансдермальной потери воды против использования ткани и воды у недоношенных и доношенных новорожденных младенцев. Изделия, используемые для пеленания кожи не должны содержать летучий алкоголь (этил и изопропил), ароматические и раздражающие компоненты и содержать только необходимые материалы. Инфекции кожи. Топический нистатин, миконазол, клотримазол и циклопирокс предназначены для лечения кандидозного пеленочного дерматита у младенцев. Нистатин назначается педиатрами наиболее часто. Комбинации противомикотиков и кортикостероидов средней и высокой потенции (например, нистатин и триамцинолон, клотримазол и бетаметазон дипропионат) не рекомендуются вследствие возможной атрофии кожи от стероидов и способности окклюзионной среды увеличить их проникновение. Лечение циклопироксом обеспечило существенное уменьшение тяжести и увеличение эффективности лечения среди 48 младенцев (6-29 месяцев). Его рекомендуют из-за дополнительного (антибактериального и противовоспалительного) эффекта. В плацебо-контролируемом исследовании субъектов с острым пеленочным дерматитом, те, которые использовали 0.25 % миконазола нитрат в оксиде цинка на основе вазелина (n = 101) имели значительно более низкую частоту высыпаний, чем группа контроля, которая получала оксид цинка на вазелине (n = 101). Самые большие изменения были у субъектов с умеренно-тяжелой сыпью и с кандидозом. Другое безопасное исследование установило, что системное поглощение миконазола нитрата было низко у младенцев с пеленочным дерматитом. Лечение бактериального пеленочного дерматита должно базироваться на вовлеченных микоорганизмах. Топическое лечение. Идеальное топическое лечение:
• Обеспечивает полуводопроницаемый слой на поврежденной коже, чтобы облегчить репарацию барьера рогового слоя;
• Обеспечивает физический щит между кожей и раздражителями;
• Сохраняется местно на коже (не удаляется с испражнениями);
• Поддерживает кислотную мантию (кислое pH);
• Позволяет легко очищать кожу. Одноразовые AGM подгузники с веществами на внутренней поверхности были представлены в конце 1990 гг. Более 24 часов 0.17 мг/см вазелина может доставляться в кожу здоровых младенцев (n = 391; 8-24 месяца), ношение подгузников, содержащих вазелин, стеариловый спирт и алоэ привели к значительному уменьшению эритемы в области промежности и половых органов, чем в группе контроля (без обработки внутренней поверхности). AGM с вазелином, стеариловым спиртом и окисью цинка были сравнены с контролем (AGM без добавок) у здоровых младенцев (общее количество n = 268; средний возраст: 9.9 месяцев). Испытательные образцы имели значительно более низкую частоту подгузничной сыпи (промежность, половые органы, ягодицы и складки нижних конечностей) чем младенцы контроля. Снижение тяжести пеленочной сыпи было обнаружено для AGM подгузников с вазелином и окисью цинка по сравнению с подгузниками, содержащими только вазелин, но об определенном количестве не сообщалось. Методическое руководство к изделиям для кожи
Топические изделия включают защитные крема, экраны, пасты, защитные средства для кожи, барьеры для влажности и увлажняющие крема. Многие производятся при одобрении FDA в США в ходящие в монографию как средства, имеющие право использоваться в качестве «Лечебных защитных средств для кожи для законного человеческого использования». В этой монографии, защитные средства для кожи «обеспечивают временное облегчение от вредных или раздражающих стимулов», и позволенные компоненты внесены в список в Таблице 3. Отмеченные (*) могут также использоваться как «временно защищающие при небольших порезах, ссадинах и ожогах». Компоненты, определяемые с (‡) могут применяться как «помогающие предотвращать, временно защищать и уменьшить шелушение или трещины кожи» на этикетке. Диметикон - единственный силикон, позволенный как защитное средство для кожи. Ланолин должен быть объединен с другими защитными средствами для использования при пеленочной сыпи. Глицерин - активный компонент при концентрации 20-45 %. Часто, глицерин присутствует в более низких концентрациях и является намеренно неактивным. Изделия обязаны иметь такие предупреждения: только для внешнего использования, не используйте при глубоких колющих ранах, серьезных ожогах и укусах животных, не использовать в области глаз, держите далеко от лица и рта, чтобы избежать его ингалации, прекратить использование или проконсультироваться с врачем, если состояние ухудшается или признаки сохряняются дольше 7 дней или появляются вновь. Порошки с каолином или крахмалом не должны использоваться на нарушенной коже. В отличие от рецептурных и некоторых законных лекарств, FDA не требует рандомизированных управляляемых клинических исследований, которые демонстрируют эффективность этих изделий до их одобрения. Поэтому, пользователи изделия не должны рассчитывать на доказанность их эффективности в адекватном управляемом клиническом исследовании. Внесение в список активных компонентов может неосторожно изменить эффективность других изделий или получить эффект плацебо. FDA не рассматривает и не дает одобрение косметическим средствам, типа «успокаивающих» или «подсушивающих».
Использование топических средств для кожи Активные компоненты. Местные изделия часто содержат окись цинка, вазелин и диметикон индивидуально или в комбинации как активные компоненты. Сообщения относительно лечения раздражительного дерматита защитными кремами привели к противоречивым результатам, с улучшением состояния кожи, обнаруженым в некоторых исследованиях и ухудшении, указанного в других. Изданное исследования относительно эффективности защитных средств кожи на пеленочный дерматит ограничено, особенно соответствующих рандомизированных управляляемых клинических исследований среди целевых популяций. Ограниченные данные могут быть следствием факта, что изделия могут быть применены без наглядной эффективности. Хоггарт оценил шесть коммерчески доступных барьерных средств, с защитным активным компонентом как:
• Мазь вода в масле (вызелин);
• Мазь без воды (диметикон);
• Паста масло в воде (окись цинка);
• Лосьон масло в воде (диметикон);
• Мазевая основа (окись цинка); Трехсоставное исследование изучало эффективность против модели раздражителя (лаурил сульфат натрия [SLS]), защиту от мацерации и создания барьера топическими агентами, использующее метод кожных аллергических проб среди 18 взрослых. Изделия применялись в течение 15-20 минут прежде, чем содержащая SLS проба была помещена на участке на 24 часа (ежедневно в течение 5 дней). Окись цинка была наиболее эффективной для защиты от раздражения, вазелин защищал против раздражителей и мацерации, а силикон привел к хорошей гидратации. Однако, испытательный метод (одно применение в день) отличается от клинической практики, где изделия применяются несколько раз в течение 24 часов. Окклюзионная аппликация существенно нарушает кожный барьер и может облегчить проникновение SLS раздражителя через лечебный барьер, а также роговой слой. Следовательно, метод вероятно не отражает механизм, который происходит, когда применяется барьерное лечение спеленутой кожи. Изучение дает важные данные для будущих клинических испытаний младенцев и взрослых со скомпрометированной кожей. Особенности изделия. Особенности изделия (компоненты) и манера использования в клинике - важные соображения. Например, толщина изделия и вязкость зависят от количества воды, липидов и макрочастиц. Более толстые изделия (пасты, крема и мази) - обычно вода, содержавшаяся в маслянных эмульсиях, с низким водным содержанием или безводные. Пасты с порошками предназначены, чтобы поглощать воду, например, для мокнущих ран. Однако, если порошок содержится в гидрофобном материале или жире (например, порошок окиси цинка в вазелине), внешняя вода не может быть поглощена. Пасты и вазелин-содержащие барьеры могут быть оклюзионными. Некоторые клиницисты против их использования в течение длительного времени или используют их только в ситуациях, где загрязнения (испражнения) содержат много воды и раздражителей. Нет никаких исследований использования вазелин-содержащих барьеров для предотвращения пеленочного дерматита в нормальной спеленутой коже. Учащение системного кандидоза было установлено у младенцев с чрезвычайно низким весом при рождении (n = 40), которых лечили местно вазелином. Возможно, что использованное количество было достаточно оклюзионным, чтобы задержать развитие барьера рогового слоя и/или допустить рост коагулазо-негативных стафилококков. Пока причина увеличенния частоты инфекции не понята, использование вазелин-содержащих, низко-гидратирующих мазей у недоношенных младенцев останется спорным. Другие наружные средства. Комбинация окиси цинка и декспантенола в проводнике (жидкий парафин и воск) была сравнена с одним проводником парным сравнением (на разных сторонах области пеленания), испытанных на 46 младенцах с диареей. Декспантенол поглощается и конвертирует в пантотеновую кислоту с известными эффектами на репарацию эпидермиса. Трансдермальная потеря воды была значительно ниже при обработке 3 раза в день, но различия в количестве пеленочной сыпи узорчатой не были установлены. Окись цинка (47 %), эозин (2% раствор) и кортикостероид (клобетазона бутират) были сравнены среди 54 здоровых младенцев с умеренной пеленочной сыпью, и эозин обеспечил самое большое улучшение (против основы). Общее количество 25 младенцев (1-48 месяцев) с раздражительным дерматитом (20), атопическим дерматитом (3), псориазом (1) и стрептококковым дерматитом (1) обрабатывали защитным кремом с окисью цинка, витамином E и пантенолом ( этиловая форма пантотеновой кислоты) в течение 14 дней. Кандидоз у 12 младенцев лечили одновременно с топическим противогрибковым средством. Улучшение, обозначенное как «клиническое заживление» (13), или существенное сокращение дерматита (9) было обнаружено у 21 младенца.
Обзор исследования Кохрейна эффективности витамина А (ингредиент защитного средства для кожи с маслом печени трески (Таблица) 3) для лечения и/или предотвращения пеленочного дерматита. Одно изучение, исследующее 114 новорожденных не сообщило ни о каких различиях в эффективности мази с витамином А против транспортного средства при пеленочном дерматите. Существенное улучшение более чем за 5 дней было обнаружено в предварительном испытании на младенцах с умеренной эритемой с или без мокнутия, которых лечили медом, оливковым маслом и воском. Количество случаев кандидоза уменьшилось с четырех до двух. Демонстрируемая эффективность этого лечения для других дерматозов (экзема, псориаз и анальные трещины) предлагает, что дальнейшая оценка для пеленочного дерматита гарантирована.
Применение мыла и воды плюс увлажняющего лосьона было сравнено с моющим средством без полоскания в сочетании с защитным кремом в течение 3 недель у взрослых с несдержанием (n = 32) по состоянию кожи, болезненности и времени, нуждыющемся в среднем мед. персонале. Среднее количество уменьшилось для тех, кто не применяют ополаскивание/барьерную систему и увеличилось в контрольной группе (различия, не существенные, возможно вследствие небольшого объема выборки), состояние кожи значительно коррелировало с болезненностью и требуемое время было 41 минутой для тех, кто не использует ополаскивание/окклюзионный барьер против 120 минут/день для группы контроля. Это изучение обращается к важным проблемам дискомфорта пациентов и времени обслуживания медицинским штатом (непосредственно связанным с затратами) и поддерживает важность проведения исследований большего масштаба. Особые ситуации. Пациенты с состояниями, которые влияют на фекальный состав (например, синдром короткого кишечника и кистозный фиброз), могут извлечь выгоду из составов, предназначенных для смягчения определенных раздражителей. Например, холестирамин формирует комплексы с желчными кислотами для их инактивации. Местные препараты успешно использовались при тяжелых нарушениях кожи промежности у младенцев с такими диагнозами. Холестирамин в подходящей основе может быть изготовлен в больничных аптеках. Точно так же сукралфат (Карафат) использовался (мазь и порошковая форма) для лечения экскориаций в промежности от желудочных секретов. Кандидоз у этих пациентов нужно лечить совместно с противогрибковым средством. Местные пленки. Эффективность топических кремов может быть ограничена низкой устойчивостью и удалением вместе с подгузником. Существуют растворы и аэрозоли, которые высыхая формируют полупроницаемую барьерную пленку на коже. Они предназначены, чтобы сохраняться в месте нанесения и защищать кожу от прямого раздражающего контакта с раздражителями и облегчать восстановление барьера кожи. Пленки могут минимизировать повреждение кожи от очищающих процедур. Например - Сурепреп ®, несмываемое защитное средство. Он наносится на кожу в виде водного раствора, невоспламеняющийся и не имеет никаких возрастных ограничений для использования. Другой – Кавилон, несмываемая защитная пленка. Она освобождается от летучего раствора силикона и формирует полупроницаемую пленку, огнеопасна, и может быть использована у младенцев старше 1 месяца (например, не для использования у недоношенных). Кавион NSBF был сравнен с маслом окисьи цинка в параллельных группах (n = 20) взрослых пациентов с недержанием (76-92 лет) с поврежденной кожей в течение 14 дней. Улучшение состояния кожи было значительно выше для Кавилона. Сурепреп NSPBW был оценен в исследовании среди десяти младенцев с серьезными повреждениями кожи промежности. Улучшение состояния кожи, основанного на области поражения и тяжести было отмечено у восьми пациентов (два, были освобождены от обязательств и потеряны для наблюдения). В параллельных группах лечения определялась эффективность и длительность курса улучшения для Сурепреп NSPBW относительно обычных защитных кремов. Другие ингридиенты и младенцы. Изданные исследования относительно эффектов многочисленных изделий, которые влияют на барьер кожи младенцев, очень ограничено. Изделия для здоровья и ухода за кожей обычно проверяются на взрослых и/или полагаются на опыт (малое количество неблагоприятных эффектов), чтобы разрешить использование у младенцев. Они могут содержать компоненты, которых по-возможности нужно избегать или использовать с осторожностью. Например, изделия, содержащие борную кислоту не рекомендуются вследствие ее токсичности. Бензалкониум хлорид используется в изделиях ухода за кожей как дезинфицирующее средство или консервант и должен быть проверен до использования на младенцах. Он может вызвать аллергический дерматит у младенцев. Перспективы будущего Следующие современные разработки могут быть уместны для лечения или пофилактики пеленочного дерматита в течение следующих нескольких лет. Семя подсолнечника и масло сафлоры Семя подсолнечника и масло сафлоры, нанесенное на поверхность кожи недоношеных младенцев продемонстрировали сокращение внутрибольничных инфекций в развивающихся странах. Масло семени подсолнечника улучшает эпидермальную барьерную функцию, тогда как масло горчицы, обычно используемое для ежедневного младенческого массажа, оказалось, наносило вред. Основанный на механистических исследованиях, барьерный эффекты этих масел может привести к уменьшению и лечению раздражительного пеленочного дерматита. Белок картофельных клубней Рюзлер-ван Эмбден идентифицировал белок в картофельном клубне, который ингибирует протеолитическую активность ферментов в фекалиях как метод, позволяющий уменьшить экскориации в области промежности и продемонстрировал доказательство концепции в клиническом изучении. Первородная смазка Пленки с первородной смазкой препятствовали проникновению экзогенного химотрипсина (обнаруженного в меконии/первородном кале), но сохраняли активность эндогенного фермента (необходимого для эпидермального развития) in vitro. Лечение поверхностных травм рогового слоя (ссадненная пластырем кожа) первородной смазкой облегчило репарацию барьера в сравнении с контролем. В образцовых системах, лечение первородной смазкой ускоряло формирование рогового слоя, не увеличивая толщину эпидермиса. Синтетический аналог первородной смазки с высоким содержанием воды замедляет потерю воды и испарение родной первородной смазки. Церамиды рогового слоя Церамиды 1 и 3 рогового слоя были эффективны в восстановлении повреждения барьера после снятия пластыря и атопическом дерматите в лаборатории и in vivo. Изделия с церамидами 1 и 3 уменьшили трансдермальную потерю воды и увеличили гидратацию более чем за 4 недели после променения раздражителя. Эффективность изделий, содержащих церамиды при раздражающем пеленочном дерматите и хроническом воспалении нуждаются в дальнейшем исследовании и конечно оправдана. Управление pH кожи при пеленочном дерматите
Уменьшение pH кожи в месте применения подгузника представляет потенциальную стратегию для того, чтобы улучшить состояние кожи. Кислая pH необходима для эффективного функционирования ферментов в роговом слое и его целостности и вносит вклад в врожденную иммунную функцию рогового слоя, подавляя колонизацию патогенов (например, S. aureus). Частота восстановления барьера увеличилась после применения pH 5.5 буферов. Были разработаны салфетки с pH буферами. Лечение с использованием новых салфеток привело к значительному снижению pH кожи, чем стандартными пеленками и водой в исследовании среди недоношенных и доношенных младенцев высокого риска. Управление недержанием Системы для управления недержанием предлагают другой подход для того, чтобы улучшить состояние спеленутой кожи. Использование системы, включающей подгузник и две салфетки для чистки/защиты в водонепроницаемом мешочке, привели к большей частоте использования салфеток и уменьшению времени ухода. Использование устройства для того, чтобы управлять недержанием кала (Flexi-Seal ®) поддерживает или улучшает состояние кожи у 92 % пациентов стационара и ожидает дальнейшую оценку экономической эффективности. Методы оценки кожи In Vivo Новые разработки неинвазивных методов и аппаратуры для оценка рогового слоя и эпидермальной функции in vivo внесут значительный вклад в фундаментальное понимание биологического ответа при раздражительном дерматите и, таким образом, приведут к развитию новых методов лечения. Например, использовалась конфокальная микроспектроскопия, чтобы определить проникновение топических масел и вазелина в роговой слой. Эффекты стресса Роль кожи в контакте с окружающей средой выдвинута на первый план областью нейроиммунологии. Например, младенец чувствует и реагирует через рецепторы кожи, чувствительные к механическим стимулам и важно для выживания. Преобразующие сигналы белки были идентифицированы. Раннее развитие является стрессом для нейроиммунной системы пациента. Психологический стресс связан с отсроченным восстановлением барьера кожи, приписанным увеличению выработки глюкокортикоидов. Стресс неблагоприятно влияет на дифференцирование, уменьшает пролиферацию клеток эпидермиса и уменьшает размер и плотность корнеодесмосом, которые отрицательно воздействуют на барьерную функцию кожи. Стресс уменьшает антибактериальные пептиды и приводит более тяжелым инфекциям кожи. Комментарии Причины пеленочного дерматита были описаны в фундаментальном исследовании, изданном в 1980 гг и поощряли развитие технологий, увеличивающих поглотительную способность и уменьшающих гидратацию кожи. Процент сокращения нарушений кожи в клинических назначениях стимулировал поиск дальнейших улучшений. Все же, есть несколько рандомизированных управляемых клинических испытаний среди самых уязвимых популяций, типа недоношенных младенцев, младенцев с врожденным абстинентным синдромом и взрослых, страдающих недержанием. Важные данные управляемых исследований обязаны быть внедрены в клиническую практику и улучшать результаты лечения. Есть потребность разработать объективные, количественные методы для того, чтобы оценить состояние кожи. Недостаток опубликованных исследований может быть связан с фактом, что топические изделия для кожи не обязаны демонстрировать клиническую эффективность как защитные средства, чтобы получить одобрение для продажи. Сложная задача определить источники финансирования для их работы (то есть., учреждения здравоохранения, правительство и/или отраслей промышленности). Новая политика указывает, что федеральные агентства (например, Центры бесплатной медицинской помощи) не будут возмещать учреждениям средства для лечения пролежней. Возможно, последуют инициативы уменьшать травматизацию кожи. Скоординированные усилия среди клиницистов, исследователей и администраторов, чтобы обеспечить качественные усовершенствования были успешны. Такой подходы должен значительно уменьшить частоту раздражительных дерматозов. |
| |
| |
| |
 Главная
Главная  Recent Advances in Diaper Dermatitis: Etiology and Treatment - Форум
Recent Advances in Diaper Dermatitis: Etiology and Treatment - Форум Регистрация
Регистрация Вход
Вход
